
美國食品和藥物管理局(FDA)14日批准,中國企業百濟神州(BeiGene)自主研發的抗癌新藥「澤布替尼」在美上市。這是中國第一款在美獲批上市的自主研發抗癌新藥,年初獲FDA授予「突破性療法認定」,一舉改寫了中國抗癌藥「只進不出」的歷史。百濟神州公司總裁吳曉濱15日在京對媒體透露,美國患者有望在明年用上「澤布替尼」。在該藥針對套細胞淋巴瘤的臨床試驗中,84%以上治療患者達到總體緩解。
在創新腫瘤藥領域,中國約90%依靠進口,價格十分高昂。吳曉濱指,正是因為中國沒有,別的國家就掌控了定價權。對中國患者而言,能否吃得起抗癌藥是一個巨大的問題。
吳曉濱表示,澤布替尼在FDA獲批的喜訊,讓我們倍感自豪,這一歷史性突破代表國際對中國新藥研發水平的認可,實現了中國創新藥「走出去」的心願。更重要的是,它證明了中國創新藥企具備充分實力服務全球患者。同時,他透露該藥已在中國進入快速審批通道,相信不久也能獲批。
在華追入快速審批通道
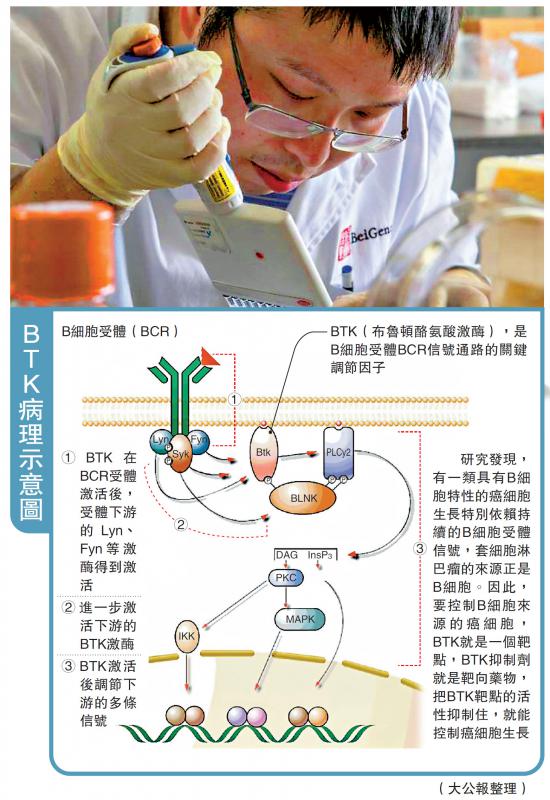
淋巴瘤是一組起源於淋巴造血系統的惡性腫瘤的統稱。目前已知淋巴瘤70多個亞型中,套細胞淋巴瘤侵襲性較強,多數患者在確診時已處疾病晚期,面臨着治療手段有限、預後不良的困境。
吳曉濱介紹,此次獲批的澤布替尼是一款新型強效BTK抑制劑,目前正作為單藥或與其他療法聯合用藥,在多種淋巴瘤治療中開展臨床試驗。在針對套細胞淋巴瘤的臨床試驗中,84%以上治療患者達到總體緩解。今年1月,澤布替尼曾獲FDA授予的「突破性療法認定」,成為首個獲得該認定的中國研發抗癌新藥,這一認定也加速該藥在美國的審批。8月,FDA正式受理澤布替尼新藥上市申請,並授予其優先審評資格。
百濟神州創建於2010年,在2016年和2018年分別於美國納斯達克交易所及香港交易所掛牌上市。在「澤布替尼」獲批之前,公司成立9年還沒有自主研發產品獲批上市,產品銷售收入主要依靠其他藥企授權銷售的產品。
為了研發新藥,公司一直處於虧損狀態,被稱為最「燒錢」的中國藥企。吳曉濱透露,去年公司研發投入46億元人民幣,是全國研發投入第一。2012年7月,研究團隊正式對BTK開發項目立項,最終在500多個化合物中,選定了最終候選分子,為其編號BGB-3111,意為百濟神州成立後做出的第3111個化合物。
澤布替尼主要發明人之一、百濟神州化學研發負責人王志偉介紹,最初立項時目標就很明確,一定要做一個選擇性高、對靶點抑制非常專一的化合物。通過優化分子結構,希望將BTK靶點的特異性結合率達到最大化,並最大程度減少脫靶現象,降低不良反應發生率。同時,通過改進工藝,力求藥物在體內更好吸收。
歷時7年研發 超20國臨床試驗
「澤布替尼最初的目標就是做世界最好的BTK抑制劑。」百濟神州高級副總裁汪來說,百濟神州是在北京昌平開始的,我們經常有一句玩笑話叫「We are the Champion,我們在昌平」。如今,中國製藥邁出了一小步,更有機會在未來5年、10年角逐於世界舞台。
2014年,澤布替尼在澳洲正式進入臨床階段,同年8月完成全球第一例患者給藥。從最初立項到正式在FDA獲准上市,澤布替尼研發歷時超過7年。截至目前,澤布替尼在全球的臨床試驗覆蓋國家超20個,超過1600位患者接受了治療。